阿斯利康&第一三共发布新一代靶向 HER2 乳腺癌药物积极数据!
按:HER2 是一个经典靶点,相关药物过去曾给乳腺癌患者带来巨大的临床获益,日前,一项针对 HER2 阳性转移性乳腺癌患者使用 trastuzumab deruxtecan 的关键 II 期临床试验结果显示,肿瘤客观缓解率达到 60.9%,这个由阿斯利康和第一三共联合开发的药物展示出令人印象深刻的疗效,患者中位无进展生存期也达到了 16.4 个月。
阿斯利康和第一三共近日公布了针对 trastuzumab deruxtecan (DS-8201)的全球关键性 II 期单臂临床试验(DESTINY-Breast01)的详细数据。这是一款靶向 HER2 的抗体偶联药物(ADC),用于此前接受过两种或两种以上抗 HER2 治疗的 HER2 阳性转移性乳腺癌患者。
在接受 trastuzumab deruxtecan(5.4毫克/千克)治疗的患者中,经独立中央评估确认,作为主要终点的客观缓解率(ORR)达到60.9%。入组患者此前接受过中位达6线(2-27)的针对转移性疾病的相关治疗。
患者的疾病控制率(DCR)为 97.3%,中位缓解持续时间(DoR)为 14.8 个月,中位无进展生存期(PFS)为 16.4 个月。试验尚未达到患者中位总生存期(OS),患者一年生存率估计为86%。相关结果在各类患者亚组中保持一致。
丹娜法伯癌症研究所 Susan F. Smith 女性癌症研究中心乳腺癌研究中心副主任,DESTINY-Breast01 试验首席研究员 Ian E. Krop 表示:“这些结果特别引人注目。Trastuzumab deruxtecan 能够在很大程度上帮助患者实现持久的肿瘤减灭,而其中大多数患者已几乎用尽了 HER2 转移性乳腺癌的所有标准疗法。我们对这些结果感到兴奋,它有望为晚期乳腺癌患者带来帮助。”
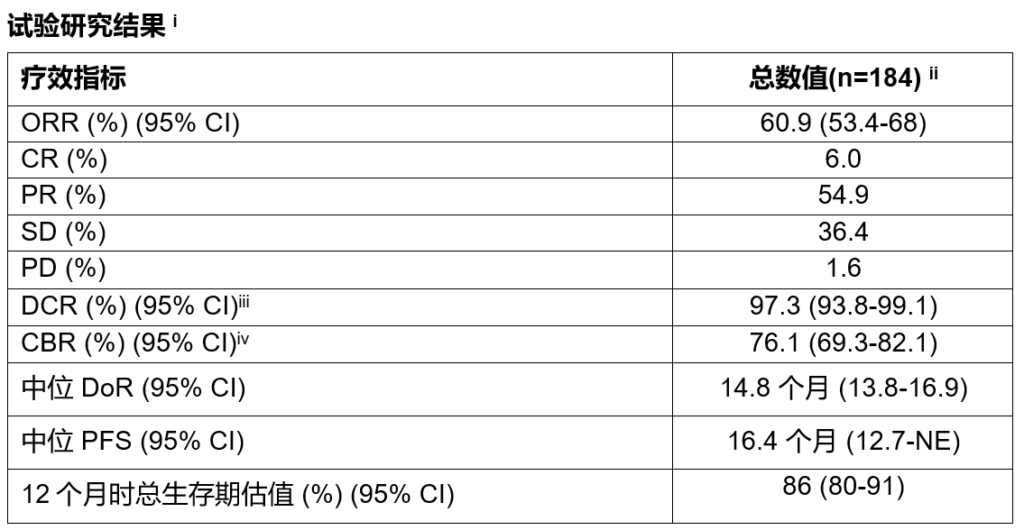
CI,置信区间;CR,完全缓解;PR,部分缓解;SD,稳定疾病;PD,进行性疾病;NE,不可估量。
i 经独立中央审查评估
ii 5.4毫克/公斤
iii DCR为(CR + PR + SD)
iv CBR为(CR + PR + SD≥6个月)
相关数据已在 2019 年圣安东尼奥乳腺癌研讨会上对外发布,并同时在线发布于《新英格兰医学杂志》。
患者此前接受的疗法包括曲妥珠单抗-美坦新偶联物(100%),曲妥珠单抗(100%),帕妥珠单抗(65.8%),其他抗 HER2 治疗(54.3%),激素治疗(48.9%)以及其他系统性治疗(99.5%)。trastuzumab deruxtecan 的中位治疗时间为10个月(0.7-20.5),中位随访时间为11.1个月(0.7-19.9)。截至 2019 年 8 月 1 日的数据,仍有 42.9% 的患者在接受治疗。
在 DESTINY-Breast01 试验中, trastuzumab deruxtecan 的安全性与耐受性与 I 期试验中所观察到的保持一致。最常见的 3 级或更高级别的治疗相关紧急不良事件包括中性粒细胞计数减少(20.7%),贫血(8.7%),恶心(7.6%),白细胞计数减少(6.5%),淋巴细胞计数减少(6.5%)和疲劳(6.0%)。总体而言,通过独立审查确定,有 13.6% 的患者确诊患有与治疗相关的间质性肺病(ILD)。相关不良事件的严重程度主要为 1 级或 2 级(10.9%),仅有一例为 3 级(0.5%),无 4 级不良事件。有4例死亡事件(2.2%)被确定归因于 ILD。
最近,美国食品药品监督管理局接受了 trastuzumab deruxtecan 用于治疗 HER2 阳性转移性乳腺癌患者的上市申请,并授予其优先评审资格。公司还向日本厚生劳动省提交了药品上市申请。
随着 trastuzumab deruxtecan(DS-8201)的加入,阿斯利康肿瘤业务实现了四大关键科学平台的完全覆盖:肿瘤驱动和耐药性,DNA损伤反应,免疫治疗和抗体-药物偶联物。而且,从以“三得”为代表的乳腺癌经典内分泌治疗方案到以“奥拉帕利”为代表的靶向治疗药物,再到如今DS-8201这一ADC产品的惊艳问世,阿斯利康也将成为乳腺癌领域产品线最全的外资制药公司之一。