个人也可有药品批文!国务院部署10省试点

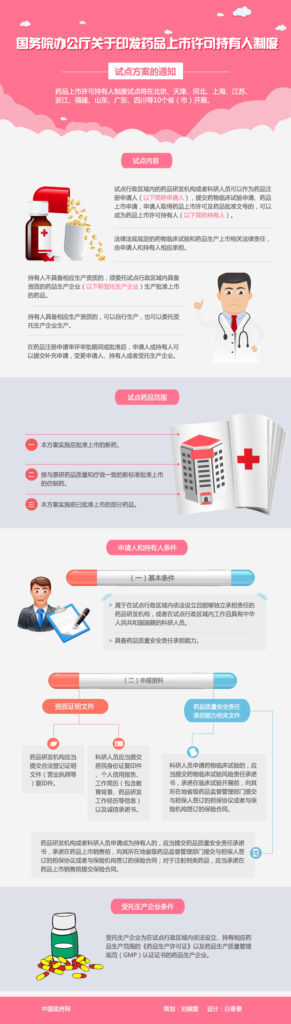
新华社北京6月6日电 国务院办公厅日前印发《药品上市许可持有人制度试点方案》,对开展药品上市许可持有人制度试点工作作出部署。在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川等10省(市)开展试点工作。
开展药品上市许可持有人制度试点是药品审评审批制度改革的一项重要内容,有利于药品研发机构和科研人员积极创制新药,有利于产业结构调整和资源优化配置,促进专业分工,提高产业集中度,避免重复投资和建设,对于鼓励药品创新、提升药品质量具有重要意义。
《方案》提出,试点行政区域内的药品研发机构或者科研人员可以作为药品注册申请人,提交药物临床试验申请、药品上市申请,申请人取得药品上市许可及药品批准文号的,可以成为药品上市许可持有人。申请人和持有人应当履行《中华人民共和国药品管理法》以及其他法律法规规定的有关药品注册申请人、药品生产企业的义务,并且承担相应的法律责任。
《方案》明确,试点药品范围包括方案实施后批准上市的新药、按与原研药品质量和疗效一致的新标准批准上市的仿制药以及方案实施前已批准上市的部分药品。麻醉药品、精神药品、医疗用毒性药品、放射性药品、预防用生物制品、血液制品不纳入试点药品范围。
《方案》规定了新注册药品、已批准药品申报上市许可持有人的基本程序,并对批准证明文件内容、试点品种的说明书及包装标签、试点品种的药品批准文号效力、审批信息及监管信息公开等提出了具体要求。对药品研发机构或者科研人员参加试点工作的申请,要求承诺提供担保协议或者与保险机构签订的保险合同。
《方案》明确,批准上市药品造成人身损害的,受害人可以向持有人请求赔偿,也可以向受托生产企业、销售者等请求赔偿。属于受托生产企业、销售者责任,持有人赔偿的,持有人有权向受托生产企业、销售者追偿。属于持有人责任,受托生产企业、销售者赔偿的,受托生产企业有权向持有人追偿。具体按照《中华人民共和国侵权责任法》等的规定执行。
《方案》要求,持有人所在地省级药品监督管理部门负责对持有人以及批准上市药品的监督管理,对不在本行政区域内的受托生产企业,应联合受托生产企业所在地省级药品监督管理部门进行延伸监管。生产企业所在地省级药品监督管理部门应当加强对药品生产者实施生产的监督检查,发现生产、经营环节存在风险的,及时采取控制措施。
《方案》自印发之日起,实施至2018年11月4日。试点行政区域内的药品生产企业参照本方案中持有人的有关规定执行。