儿科药红利?其实是艰难的突围战!
临床需求
带动儿童药升量的两大引擎
儿科看病有多难
根据国家卫生计生委数据,我国目前有2.3亿14岁以下的儿童,占全国总人口的16.6%,随着全面二胎政策落地,预计新生儿数量将在未来几年呈递增态势,每年将新增新生儿约300万~400万人。
2015年,儿科门急诊人数达5.4亿人次,占全部门急诊人数的9.6%。儿童医疗服务刚需强劲,但我国儿科服务的资源整体总量不足且配置结构不尽合理。儿童专科医院仅有99家(其中公立医院69家,私立医院30家),仅占全国医疗机构的0.38%,且主要集中在东南大中城市,资源分布严重不均。儿科床位25.8万张,仅占全国医院总床位数的6.4%,儿童医院病床使用率一直处于高位,2014年达到103.8%。
儿童“看病难”主要矛盾发生在季节性儿童疾病的高发期,儿童集中就医,大城市儿科专科医院都出现了非常紧张的局面。最近各城市禁止加号后,更是加大了儿童就医的难度,去大医院挂不上号,去社区医院全科医生又自谦经验不足请患儿转医大医院。分级医疗分流患者的目标和流程达成了,然而对于患者而言,“看病难”的问题不但没有解决,反而是难度升级。
“十三五”扩容力度
短期儿童“看病难”矛盾难以调和,那么国家的长期投入又是如何呢?
“十三五”时期,国家将增加儿科医疗资源的供给,加大投资力度,力争实现每个省区市都能有一所儿童医院,常住人口超过300万的地级市设置一所儿童医院,二级以上的综合医院都要设置儿科,县级的公立医院和儿科需求量比较大的城市的公立医院也要设置儿科病房。每个省市县都要设置一所政府举办的标准化妇幼保健机构,将儿童家庭作为基层全科医生、家庭医生重点签约的对象,引导社会力量来举办儿童的医疗机构。这意味着,2020年国内的儿童“看病难”将有望得到解决,儿科医院数量的扩容将带动儿童药市场升量。
药品格局
儿科药究竟“缺”什么?
这边厢,儿科药品“成人化”成为儿科药品缺乏的重要证据。有数据指出,国内市场90%的儿童使用的是成人药物的减量版。
说明书最常见的字眼就是“小儿酌情减半”“遵医嘱”或“慎用”等字样,对于家长实际使用而言,无法准确推断药品用量,药品服用的依从性和便利性非常差。针剂同样有最小剂量仍超过儿童所能注射的最高剂量的问题。
除了药品说明书用法用量不完善,药代动力学未标准至儿童、未经临床确定的供儿童使用安全有效的信息缺乏,也是我国儿科药品显著的问题。这些问题并不是我国独有的,而是全世界的共性问题。
儿科临床试验难做是现有研发的主要难点之一。将儿童纳入临床试验的伦理因素、受试儿童患者不足的人口因素、短缺的儿科医生研究者因素、有待提高的研究技术因素、制药企业高风险低回报的经济效应因素等,都是儿科临床试验难以开展的影响因素。儿科临床研究不足进一步增加了针对儿童的适应症获批的难度,导致儿科药品的缺药无法避免。
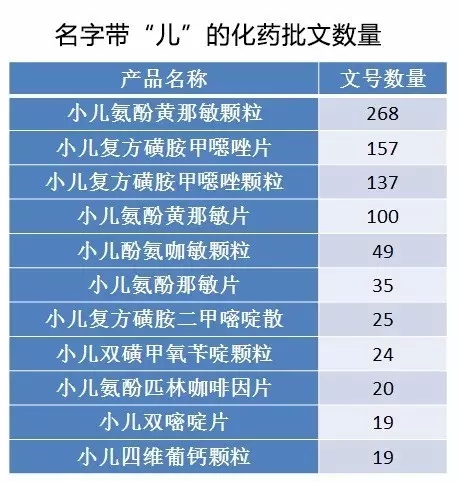
那边厢,目前已上市的儿科药品的竞争激烈,普遍厂家的销售额业绩平平,销售额排前列的产品的市场占有率也较低,显示出儿科药品的市场竞争非常激烈。这主要根源是已上市的儿科用药产品同质化较严重,化药基本是多家生产的,中成药虽然产品名为独家,组方略有不同,但适应症趋于雷同。
我国儿童药缺的是未在我国上市但在欧、美、日上市的临床必需的治疗用药,以及从安全性和服用便利性考虑的日常常见疾病成人用药延伸至儿童使用的小规格;最不缺的则是同质化较严重、生产厂家数较多的化药普药和适应症雷同的中成药。
头脑风暴
政策、立项、营销的对策
1.立项考量:关注儿童疾病谱变化
儿科药品的立项首先要关注临床需求。随着我国经济水平的发展,儿童健康需求亦有所改变。我国目前学龄前儿童体格发育状况良好,低体质量、生长迟缓、消瘦发生率较低,但超重及肥胖的发生率增高,儿科药品的开发可以关注由于偏食所导致的营养不良,超重和肥胖以及相关并发症等疾病。
由于环境污染等因素,儿童肿瘤患病率增加。良性软组织肿瘤是儿童最常见的良性肿瘤。恶性肿瘤中,以淋巴、造血系统和有关组织肿瘤占首位,其次为起源于胚胎组织的神经母细胞瘤。儿童动态未定和未知肿瘤以颅内及椎管内肿瘤占首位。肿瘤是国家关注的重点领域,研发儿童肿瘤有望获得加快审批等政策扶持。
此外,双重特殊儿童的数量增加值得关注。双重特殊儿童,是指那些在某些领域拥有超常能力,但同时又伴有某些障碍的儿童。这些儿童智力或能力超过正常人但身心有缺陷,如听力障碍、视觉障碍、肢体残疾、语言障碍、情绪情感异常等。目前双重特殊儿童研究主要集中在特殊学习障碍儿童、注意缺陷多动障碍儿童和自闭症儿童这三大类别上,药物治疗对以上类别儿童而言效果一般,仍有进一步深挖的潜力。
2.政策扶持:借鉴美国“他山之石”
美国通过实施《儿童最佳药品法案》与《儿科研究公平法案》来激励并强制儿科专用药的临床研究。按照FDA批准的书面请求完成儿科研究的专利药品,将被授予在其原有的专利期之后增加长达6个月的儿科独占期的奖励。无法获得儿科独占期的非专利药品,则依据规定给予一定数额的专项研究拨款。此外,新药申请或补充申请时,除非经FDA同意准予延期或免除儿科评价,否则都必须进行儿科评价。
针对儿科专用药研发困难、企业在某些领域研发积极性不高的状况,美国政府采取了与制药企业合作研究开发儿科药品临床试验的方式,促进药品的研发和审批程序,从而实现成果快速转化。
鉴于此,我国政府也可主动探索与制药企业在基础研究和非专利药儿科临床试验的合作,选择儿科需求量较大但尚无儿科专用药的非专利品种进行研究。此外,政府还可通过各类基金与企业签订合作开发协议,为特定儿科药物的临床研究提供技术、设施和资金支持,合作中获得的专利证书属于政府和企业共同所有,允许企业保留专利,并且企业可以利用该权利深入开发产品并推动产品上市,加速研究成果的审批和商业化。
3.营销突围:临床证据挖掘和OTC布局
我国目前上市的儿科药品主要是生产厂家数较多的化药普药和适应症基本相同的中成药。生产厂家数较多的儿科化药普药,通常上市时间都非常久,临床处方医生对此类药品都非常熟悉,价格也由于多家竞标早已成为低价药水平。这类药品的生产厂家基本没有推广费用,日常销售主要靠自然销售,也基本没有突围的需求。
有推广空间且有突围需求的,往往是价格维护较好且独家的中成药。此类药品虽然有妇儿药挂网采购的利好,但在医院覆盖中往往受到医院限制辅助用药和中成药等政策阻击,难以在医院层面上有所作为。
进入临床途径或指南,将是中成药的主要突破点,而这个突破点现在越来越讲究临床证据。因此,儿科中成药营销突围首先就要做中药再评价试验,挖掘临床证据,证实其安全性和临床使用的必要性,才能在医院目录中博得一席之地。
此外,生产厂家不妨尽早布局OTC终端,因为医疗资源紧缺将带动部分家长为便利而在OTC购药。
不过,生产厂家在进入OTC终端前,须根据产品特点和企业资源对产品进行更符合OTC销售的品牌定位,对产品进行二次开发,如产品的外观设计、口感口味等,这将有助于产品在OTC终端突围。生产厂家也可以考虑通过贴牌、并购等方式扩充自己的产品线,通过系列组合方式整合各种差异化的产品,推出整体品牌,发挥品牌的协同作用,提升品牌的知晓度。